在细胞的精细调控网络中,表皮生长因子受体(EGFR)家族如同一群掌控生长与分化的“指挥官”,通过精准接收外部信号来调节细胞的增殖、凋亡与迁移。但是,当这些“指挥官”因基因突变、扩增等因素失控时,它们便会转变为癌细胞快速生长的“帮凶”。EGFR家族作为癌症治疗领域的核心靶点,其研究历程不仅揭示了肿瘤发生的关键机制,更推动了从单克隆抗体到小分子靶向药物的革命性进展。
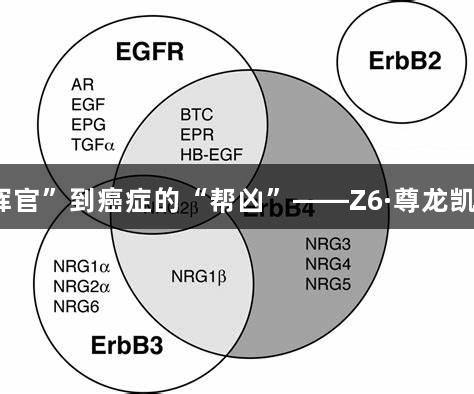
EGFR家族由四位成员组成:EGFR(HER1)、HER2、HER3和HER4,作为跨膜酪氨酸激酶受体,它们通过“胞外结构域识别信号-跨膜结构域传递信号-胞内结构域激活通路”的三级联动,构成细胞生长的调控中枢。在正常组织中,EGFR家族充当发育与稳态的守护者,但在肿瘤中却因多重机制走向“叛变”。EGFR信号通路失控为癌细胞提供了三大“生存武器”:加速G1/S期转换的增殖引擎、抑制线粒体凋亡通路的抗凋亡护盾、以及促进基质降解与血管新生的转移助力。这些变化共同形成肿瘤恶性演进的分子基础。
针对EGFR家族的靶向药物采用“胞外阻断”与“胞内抑制”双重策略展开攻势,然而耐药性依然是一个严峻的挑战。EGFR家族的研究历程,实际上是一部从基础分子机制向临床转化的“精准医学进化史”。尽管耐药性仍是当今的瓶颈,但复杂的调控网络也为新药研发提供了丰富的靶点——从HER3抗体MM-121到双特异性抗体MM-151,再到表观调控和肿瘤微环境干预的多学科交叉,正在催生更多的创新疗法。
展望未来,随着液态活检和AI辅助药物设计的普及,EGFR家族相关肿瘤的治疗将进入一个“分型更精准、耐药可预测、方案个性化”的全新时代,这将使“精准打击癌细胞,保留正常细胞”的医疗愿景逐步成为现实。在这场持续数十年的“抗癌战争”中,EGFR家族既是棘手的敌人,也是关键的突破口。随着研究的深入,人类终将破译这些“信号指挥官”的失控密码,为癌症治疗开辟更广阔的精准化之路。
Z6·尊龙凯时志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli, CHO, HEK293, Insect Cells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。


